

调节性T细胞(Tregs)迁移功能缺陷可能是克罗恩病的潜在发病机制
文献来源: Gastroenterology. 2019 May;156(6):1775-1787
既往的观点与实践:
克罗恩病(CD)是一种慢性、免疫介导的肠道炎症疾病,目前尚无治愈的方法。
CD的治疗的目标包括症状缓解和黏膜愈合。但是,很多患者对当前可用的治疗方案效果欠佳。CD的治疗仍存在巨大的未满足需求。
遗传和免疫功能的研究均有充分证据,免疫调节性T细胞(Tregs)功能缺陷,与炎症性肠病的发病机理有密切的关系。
肠道免疫状态的稳定或异常,取决于炎性效应T细胞(Teff)与免疫调节性T细胞(Tregs)的平衡。
近年来,CD治疗的最新研究进展集中在效应T细胞的迁移。具体来说,通过特异性阻断T细胞肠道迁移分子整合素α4β7,可以使效应T细胞不能聚集在肠道。
该治疗方法的有效性表明,效应T细胞细胞迁移至发炎的肠道,是CD发病机制中的关键步骤。
Treg细胞是一类独特的CD4+T细胞,具有强大的免疫抑制作用,可以限制局部的免疫反应。
遗传学研究显示,Tregs功能异常的小鼠或人类,会发展出多种严重的系统性炎症疾病,包括慢性肠道炎症。
因此,通过调节Tregs细胞的迁移或炎症抑制功能,是另一个基于CD发病机制的治疗思路。
CD的发病机制,涉及肠道组织的调节性T细胞和效应性T细胞失衡。因此,调节性T细胞是否可以正常迁移至肠道,是非常重要的问题。
存在的问题:
克罗恩病(CD)的疾病特征,是肠道组织中效应T细胞和调节性T细胞失衡。
抗-整合素药物(如维多珠单抗)对于CD治疗的有效性,提示抑制效应T细胞的肠道迁移可有效控制肠道炎症机制。
另一方面,调节T细胞(Treg)的肠道迁移是否参与了CD的发病机制,干预这一过程是否也可以产生CD的治疗效果?
回答这一问题有可能进一步揭示CD的发病机制,开发出全新的CD细胞疗法。
这项研究有什么新发现:
这是一项基础科学研究,从CD患者和健康个体(对照组)的外周血或固有层中,分离出Treg细胞,分析Treg细胞整合素α4β7的表达水平。
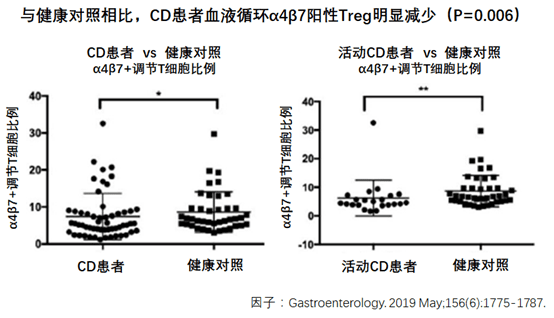
研究发现,CD患者Treg细胞表达的整合素α4β7的水平,低于对照组的健康个体。
维甲酸(RA)可以诱导整合素a亚基的表达,提高CD患者Treg细胞表达高水平的整合素α4β7,从而提高Treg细胞的免疫抑制能力。
分析发现,这些Treg细胞的免疫抑制能力更强,并能正常完成向炎症部位的细胞迁移。
总之,这项研究发现,CD患者的Treg细胞整合素α4β7表达水平低于健康对照。
将CD患者的Treg细胞离体扩增,与雷帕霉素和RARA激动剂一起孵育,可诱导α4β7的表达,发挥向炎症部位迁移和免疫抑制的功能。
未来,这些经过强化的Treg细胞,可能被开发用于CD的治疗。
启示和影响:
这项研究发现,血液中CD患者调节性T细胞的整合素b7的表达水平低于效应T细胞。
此外,CD的患者Treg细胞中整合素α4β7的表达水平,显著低于健康对照者。
因此,CD患者效应T细胞的迁移和运输至肠道的能力,高于调节性T细胞。这种差异具有生物学意义。
除了在血液中,CD患者肠道固有层组织中,调节T细胞与效应T细胞的不平衡也很明显。
CD患者中α4β7+的效应T细胞比例更高,而在健康对照者中,α4β7+的调节T细胞(Tregs)和效应T细胞(Teffs)相对平衡。
Tregs和Teffs之间的不平衡,可能是克罗恩病的潜在发病机制。CD患者Treg细胞整合素α4β7确实水平较低。
因此,通过体外诱导和增殖α4β7+的调节T细胞(Tregs),将这类细胞重新输注CD患者体内,有可能重建肠道Treg和Teffs之间的平衡,从而治疗CD。
这表明T细胞需要高水平的整合素α4β7表达,才能完成离开血管内皮迁移至肠道组织的整个过程,而且除细胞表面表达整合素α4β7之外,整合素的激活也至关重要。
其中的一个证据是,维多珠单抗(特异性阻断整合素α4β7)可完全阻断Treg细胞的迁移,证明该过程确实取决于整合素α4β7。
因此,这项研究展现了未来CD细胞的治疗的前景,将Tregs分离并体外增殖,通过体外诱导强化整合素α4β7的表达,之后用于CD的治疗。
这种强化的Tregs将特异性迁移和聚集在发炎的肠道中,发挥抗炎作用,重建肠道Treg和Teffs之间的平衡,从而治疗CD。
总之,这项研究发现CD患者的调节T细胞(Treg)表达肠道迁移分子(整合素α4β7)存在缺陷。
通过体外增殖和诱导强化,可将高度抑制性和表型稳定的自体Treg细胞转移至发炎的肠道,发挥炎症抑制作用,重建免疫平衡。
这些强化的Treg细胞在体外和体内均能维持其功能。因此,未来通过自体Treg细胞重建肠道免疫平衡,这种CD细胞疗法颇具前景。
